
Realizzato con la collaborazione della dottoressa Marchetti, D. : libera professionista in scienze statistiche
INTRODUZIONE
L’obesità era una situazione rara prima del XX secolo ora invece obesità e pandemia sono diventate quasi sinonimi e i dati italiani riflettono le previsioni poco rosee di stima dei dati epidemiologici. Infatti in Italia troviamo il 35% della popolazione in sovrappeso e il 10% obesa[3]. L'Organizzazione mondiale della sanità (OMS) l'ha riconosciuta ufficialmente come un'epidemia globale. [1]
Nel 2005 l'OMS stima che almeno 400 milioni di adulti (9,8%) siano obesi, con tassi più alti tra le donne rispetto agli uomini[2]. Secondo il settimo rapporto dell'Istituto Auxologico di Milano (Italia) sull'obesità, reso noto lo scorso anno, tra i 45 e i 64 anni, solo un uomo su tre è normopeso, mentre, per le donne, il rapporto è di uno a uno. I bambini a otto anni, età in cui si raggiunge il picco, il 36% è in sovrappeso o obeso. L’obesità sta seguendo un trend di peggioramento del 2,5% ogni 5 anni[3].
OBIETTIVO
Lo scopo è valutare un metodo pratico e veloce per il calo ponderale e il miglioramento della salute che utilizzi esclusivamente le proprietà biochimiche dei cibi, senza dare indicazioni sulle quantità, e quindi sulle calorie. Il metodo utilizzato è stato il Programma Alimentare Bioimis.
MATERIALI E METODI
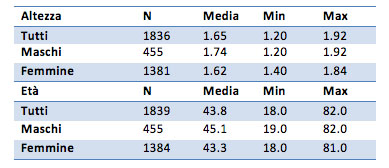
Il campione preso in esame è composto da individui di età media di 43.8 anni, l’età va dai 18 ai 82 anni (con un minimo di 18 e un massimo di 82). I maschi hanno in media un’età maggiore (45.1 anni), le femmine sono più giovani (43.3 anni).
L’altezza media è di 1.65 metri, con un minimo di 1.20 e un massimo di 1.92.
Il campione in esame ha seguito un’alimentazione senza limiti nelle quantità di alimenti e di olio extra vergine d’oliva secondo le indicazioni del Programma Alimentare Bioimis. Ogni persona ha ricevuto un menù composto da colazione, pranzo e cena da rispettare per 2 giorni consecutivi, il secondo giorno la persona chiamava e gli veniva fornito il menù successivo per ulteriori 2 giorni.
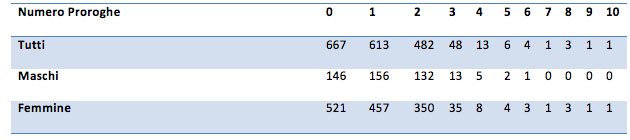
Per la seguente analisi sono stati considerati tutti i clienti, indipendentemente dal numero di mesi di Forma Ideale sfruttati.
Si riporta la tabella con le frequenze di clienti per numero di mesi di Forma Ideale:
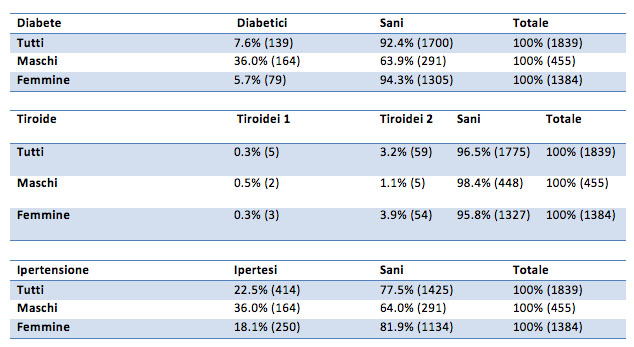
All’interno del campione utilizzato per l’analisi sono presenti individui con alcune patologie come il diabete, l’ipertensione e le malattie della tiroide .
Nello specifico circa il 7% del campione è diabetico, il 3% ha alterazioni della funzionalità della tiroide e il 22% è iperteso.
RISULTATI
Considerando la tipologia delle variabili da analizzare (quantitative) e avendo come obiettivo il confronto di alcuni valori in due diversi momenti (all’inizio e alla fine del trattamento), lo strumento statistico più adatto per questa tipologia di analisi è il t test per dati appaiati[1]. Questo test confronta il punteggio medio di due gruppi e permette di capire se la differenza tra le due medie è dovuta alla casualità (legata cioè al campione preso in considerazione) o se si può definire statisticamente significativa (cioè reale, di una certa importanza ed estensibile all’intera popolazione).
Prima di applicare il t test è necessario valutare l’uguaglianza delle varianze dei due gruppi presi in considerazione (in questo caso il gruppo di soggetti è unico, preso in due momenti diversi). Per fare questa valutazione si utilizza la statistica test rapporto tra le varianze[2], quindi prima di ogni t test verrà riportato il test sulle varianze (che non verrà commentato perché non ha rilevanza concettuale per questo studio, ma solo strumentale).
Per ogni variabile di interesse viene di seguito riportata una tabella di sintesi con i valori minimi, massimi, il valore medio e la numerosità utilizzata (varia per ogni variabile a causa della presenza)
Il Peso
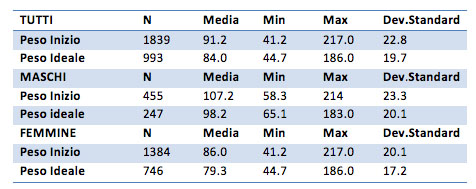
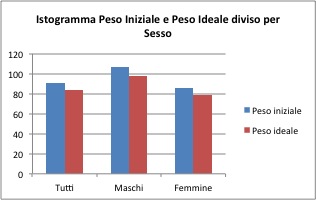
Dai valori medi ottenuti dividendo il campione in due gruppi in base al sesso si vede che i maschi sembrano avere una diminuzione maggiore del peso grazie al trattamento (differenza delle medie pari a 9 Kg) rispetto alle donne (differenza di 7Kg).
Grazie all’analisi sull’uguaglianza delle medie si potrà capire se queste differenze sono legate alla casualità del campione utilizzato oppure se si possono riportare all’intera popolazione.
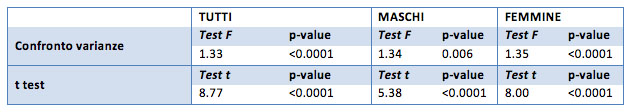
Sia per il campione generale che per i campioni divisi per sesso è stato necessario utilizzare il t test per gruppi con varianza diversa. Infatti il gruppo “dopo il trattamento” risulta avere una varianza diversa dal gruppo “prima del trattamento”. Questo significa che i due gruppi (“prima” e “dopo”) hanno una variabilità diversa (sia nel caso del campione generale che nei maschi e femmine).
Il t test è significativo in tutti i confronti: questo significa che le medie del peso “prima” sono significativamente diverse dalle medie “dopo” il trattamento, con un p-value inferiore al 0.0001.
Oltre al test riportato in tabella è stato utilizzato il t test unilaterale che aiuta a capire la direzione della disuguaglianza (cioè a capire quale delle due medie è maggiore). Nel caso del peso il test unilaterale riporta un p-value inferiore a 0.0001 a favore della perdita di peso: il peso “dopo” è in media inferiore al peso “prima”, sia nel campione generale che nei campioni di soli maschi e di sole femmine.
In media la perdita di peso per il campione generale è di 10.7Kg, il cliente che ha perso maggior peso è riuscito a dimagrire di 39Kg, mentre il cliente cha ha ottenuto minor risultato è aumentato di 2Kg.
Per il gruppo femminile la perdita di peso media è di 9.9Kg, con una perdita massima di 24.0Kg (la perdita minima è stata di -2Kg, cioè un aumento del peso).
Per il gruppo dei maschi la perdita di peso media è di 13.3Kg, con una perdita minima di -1.1Kg e una perdita massima di 39.4Kg
Per studiare la perdita di peso avvenuta durante il mese di Forma Ideale è stato fatta un’anova che studia la perdita di peso tra i due sessi.
Il risultato è concorde con quanto affermato nei passaggi precedenti: i due gruppi sono significativamente diversi (test F= 111.16 con p.value<0.001). Questo significa che il sesso del cliente influisce sulla quantità di Kg che si riescono a perdere.
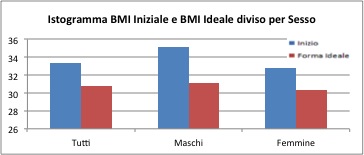
Il BMI
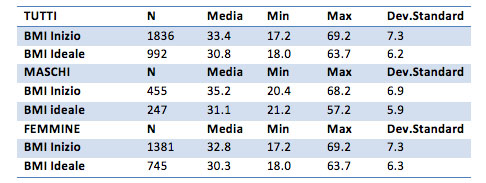
Il BMI iniziale medio è pari a 33 per il campione generale, 35.2 per i maschi e 32.8 per le femmine. Il valore medio a fine trattamento è di 30.8 per il campione totale, 31.1 per i maschi e 30.3 per le femmine.
Il gruppo delle femmine riporta maggior variabilità, con un valore minimo che va da 17 per il BMI iniziale e 18.0 per il BMI ideale fino ai valori massimi di 69.2 per il BMI iniziale e 63.7 per il BMI ideale.
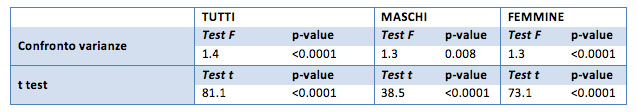
I risultati del t test per il BMI sono simili ai risultati ottenuti per il peso medio (infatti BMI è una trasformazione del peso): il t test è significativo per tutti i campioni, questo significa che il BMI iniziale è significativamente diverso da quello ideale.
Nello specifico, il test unilaterale, il BMI iniziale è maggiore (p-value inferiore a 0.0001) di quello ideale.
In generale la differenza media è di 3.9 punti, con un valore minimo di -0.9 e un massimo di 11.5.
Per il gruppo dei maschi la differenza media del punteggio “prima”-”dopo” è di 4.3 punti (con un minimo di -0.3 e un massimo di 11).
Per il gruppo delle femmine la differenza media di punteggio è di 3.8, con un valore minimo di -0.9 e un massimo di 8.9.
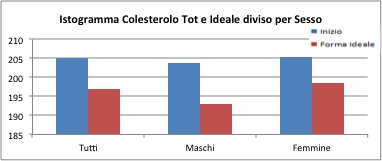
Il colesterolo
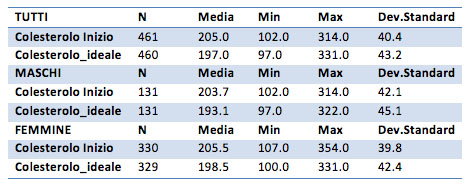
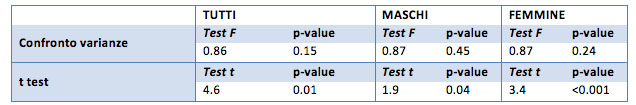
Considerando l’ipotesi unilaterale si comprende che, nello specifico, il colesterolo ideale è in media inferiore rispetto al colesterolo iniziale (p-value di <0.01).
Se si considera solamente il gruppo dei maschi, la differenza resta evidente: il colesterolo totale ideale è diverso dal colesterolo iniziale, nello specifico è maggiore di quello iniziale (ipotesi alternative con p-value di <0.001).
Per il gruppo femminile la differenza tra il colesterolo iniziale ed ideale risulta molto evidente (p-value pari a 0.001). Anche in questo caso risulta che il colesterolo ideale è minore (p-value ipotesi unilaterale pari a 0.0003) rispetto al colesterolo iniziale.
In media il colesterolo diminuisce di 8 mg/dl, con una perdita massima di 170 mg/dl e una perdita di -134 mg/dl (cioè un aumento).
Per il gruppo maschile la differenza è di ben 10 mg/dl (perdita minima di -134 e massima di 170), mentre per il gruppo femminile e di 6 mg/dl (valore minimo di -120 punti e un valore massimo di 165)
HDL
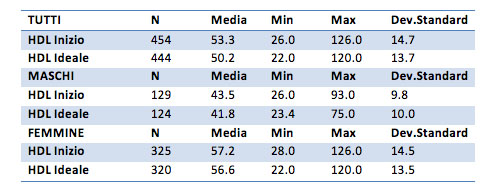
HDL iniziale è pari a 53.3 mg/dl per il campione generale, 43.5 mg/dl per i maschi e 57.2 mg/dl per le femmine. Dopo il trattamento l’HDL diventa pari a 50.2 mg/dl per il campione generale, 41.8 mg/dl per i maschi e 56.6 mg/dl per le femmine.
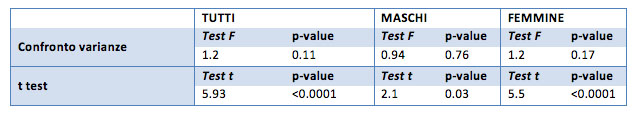
Per il campione generale e il gruppo femminile le medie del punteggio HDL “prima”-“dopo” risultano statisticamente molto significative, mentre la significatività diminuisce (p-value pari a 0.03) nel gruppo maschile.
Se si considerano le ipotesi unilaterale risulta una diminuzione del punteggio HDL tra il momento prima e il momento dopo il trattamento (p-value <0.001 per femmine e campione generale, per i maschi p-value pari a 0.01). Quindi i punteggi dopo risultano inferiori ai punteggi iniziali.
LDL
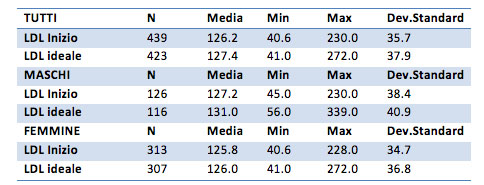
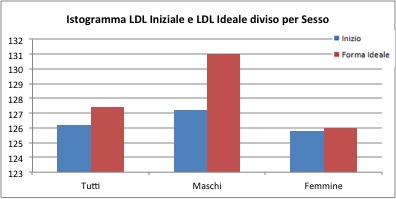
I valori medi iniziali del parametro LDL sono pari a 126 mg/dl per il campione generale, 127 mg/dl per i maschi, 125 mg/dl per le femmine. Alla fine del trattamento sono pari a 127 per il campione generale, 131 per i maschi e 126 mg/dl per le femmine. Non sembrano esserci quindi differenze sostanziali.
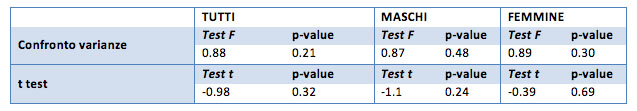
Anche il t test conferma l’uguaglianza delle medie nel campione “prima” e “dopo” il trattamento. Le piccole differenze registrate non sono quindi significative ma sono semplicemente legate al campione “scelto”.
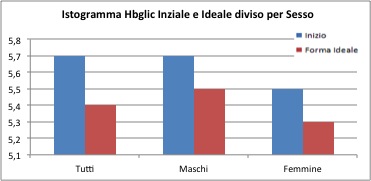
Hbglic
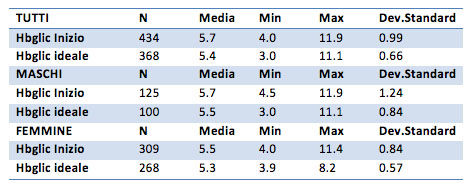
I punteggi Hbglic iniziali sono pari a 5.7%per il gruppo generale, 5.7% per i maschi e 5.5% per le femmine. I valori finali sono pari a 5.4% per il gruppo generale, 5.5% per il gruppo maschile e 5.3% per il gruppo femminile. Non sembrano valori particolarmente diversi, ma il t test verificherà la disuguaglianza.
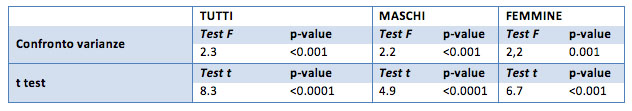
Anche se le differenze risultano piccole, il t test conferma una reale differenza tra il gruppo “prima” e il gruppo “dopo” il trattamento (sia nel caso generale, che per il gruppo dei maschi e delle femmine).
Nello specifico i punteggi dell’Hbglic iniziali si possono considerare maggiori all’inizio del trattamento (p-value ipotesi unilaterale inferiore a 0.001).
Per il campione generale la perdita media di Hbglic è di 0.36%, con una perdita massima di 5.2% e una perdita minima di -1.9% (cioè un aumento).
Per il gruppo maschile la perdita media è di 0.51% con un minimo di -1.9% e un massimo di 4.8%.
Per il gruppo femminile la perdita media durante il trattamento è di 0.30 punti percentuali, con una perdita massima di 5.2 punti percentuali e una perdita minima di -1.2 punti percentuali).
La glicemia
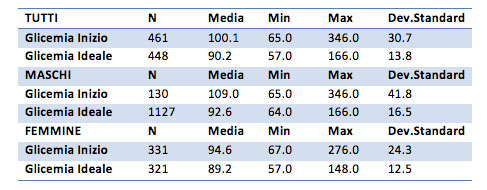
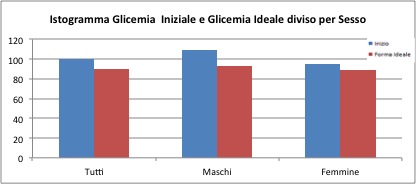
Il valore della glicemia iniziale è di 100mg/dl per il campione generale e dopo il trattamento il valore scende a circa 90mg/dl. Per il gruppo dei soli maschi il valore vale 109 mg/dl all'inizio e 92.6 mg/dl alla fine. Per il gruppo delle femmine il valore vale 94.6 mg/dl all’inizio e 89 mg/dl alla fine. Nel gruppo dei maschi è presente un valore massimo di 346 mg/dl, forse “troppo estremo” e sarebbe necessaria una verifica per controllare al veridicità di tale dato.
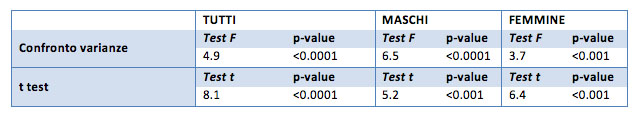
Per tutti e 3 i campioni considerati si registra una diversità significativa a livello 0.001 dei valori “prima” e “dopo” della glicemia. Considerando l’ipotesi unilaterale si evidenzia una diminuzione significativa della glicemia (p-value 0.001).
Per il campione generale la diminuzione media della glicemia è di 9.9 mg/dl, per i soli maschi la differenza è di 16.5 mg/dl, per le sole femmine è di 7.4 mg/dl.
I trigliceridi
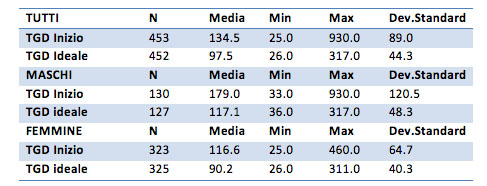
Il TGD medio per il campione generale è pari a 134 mg/dl prima del trattamento e scende a 97 mg/dl dopo il trattamento. Per i soli maschi il valore medio iniziale è di 179 punti, alla fine del trattamento è di 117. Per le sole femmine la media iniziale è di 116 mg/dl, alla conclusione del trattamento è di 90.2 mg/dl.
Nel gruppo dei maschi è presente un valore massimo di 930 punti, valore molto elevato per i trigliceridi, ma non dovuto ad errori di battitura. Infatti uno dei clienti riportava questo valore. E’ da prendere in considerazione, per un’analisi più approfondita, la possibilità di eliminare tale dato essendo dovuto a un caso molto particolare e non comune. Per l’analisi in questione è stato considerato.
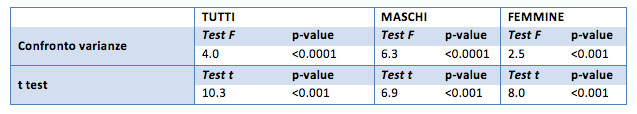
Per tutti i campioni risulta che la media iniziale è significativamente diversa dalla media a fine trattamento. Grazie al test unilaterale (p-value <0.0001) si registra che i valori medi a fine trattamento sono inferiori ai valori medi iniziali, nello specifico per il campione generale la diminuzione media è di 37 punti, per i soli maschi la diminuzione è pari 63, per le sole femmine è di 26 punti.
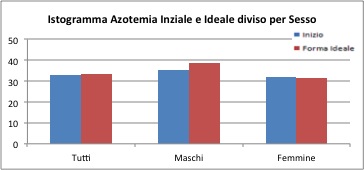
L'azotemia
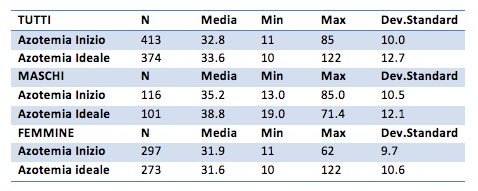
Grazie al t test sarà possibile capire se la differenza è significativa oppure si può considerare casuale (cioè legata al campione specifico).
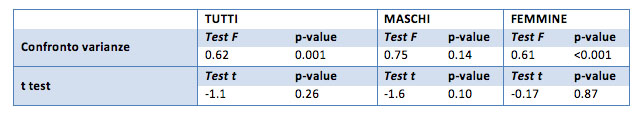
Come si vede dai p-value riportati nella tabella (tutti maggiori di 0.05) non si può ritenere che la differenza tra i valori dell’azotemia del “prima” e quelli del “dopo” sia significativa. Nemmeno le ipotesi unilaterali riportano risultati significativi.
Per questo valore non si registra quindi una differenza tra i valori “prima”-“dopo”.
La creatinemia
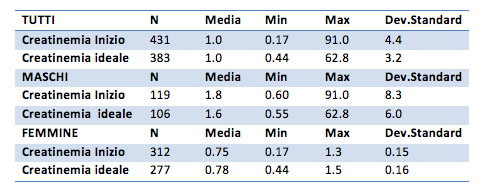
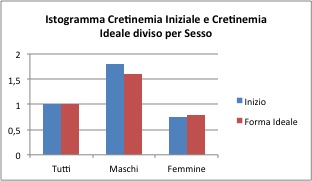
I valori medi della creatinemia iniziale sono pari a 1.0 mg/dl per il campione generale, 1.8 mg/dl per i maschi e 0.75 mg/dl per le femmine. Le medie dopo il trattamento sono di 1.0 mg/dl per il campione generale, 1.6 mg/dl per i maschi è 0.78 mg/dl per le femmine.
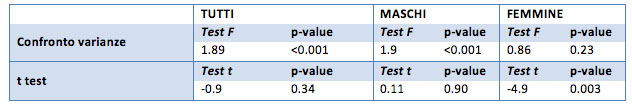
Come si poteva immaginare dalla tabella precedente, per il campione generale non sembra essere presente una differenza tra le medie prima e dopo il trattamento (p-value 0.23). Questo risulta anche nel campione delle sole femmine (p-value 0.26). Solo per il gruppo dei soli maschi risulta una differenza significativa, ma questo è probabilmente dovuto ai valori estremi raggiunti in questo gruppo sia per la creatinemia iniziale (91) sia per quella ideale (62.8). Anche in questo caso è da valutare la possibilità di non considerare questi valori.
CONCLUSIONI
In conclusione si può affermare che il trattamento ha degli effetti sulla maggior parte dei valori considerati.
Infatti, riassumendo i risultati si ottiene:
- Una diminuzione significativa del peso (e anche del BMI essendo funzione del peso), del colesterolo totale, del colesterolo HDL, dell’emoglobina glicata, della glicemia e dei trigliceridi;
Per la creatinemia, il colesterolo LDL e l’azotemia non si registrano variazioni significative.
DISCUSSIONE
Come detto il Programma Alimentare Bioimis è strutturato in due Programmi, di cui il primo costituisce un regime dietetico “non convenzionale” perché nell’ottica di massimizzare il dimagrimento punta l’attenzione sull’azione biochimica degli alimenti. L’intento di questa prima osservazione era quello di verificare la risposta dell’organismo a questo regime alimentare, al fine di escludere problematiche rilevanti per la salute dei clienti, con particolare attenzione alla funzionalità renale, considerato elemento “a rischio” nei regimi alimentari con tenore proteico superiore a quello indicato dalla dieta mediterranea. I risultati a questo proposito sono quindi da considerarsi soddisfacenti.
Attualmente è in corso un continuo monitoraggio di questi stessi clienti che forniranno esami di controllo da eseguire dopo tre mesi di mantenimento e al termine del primo anno dall’inizio del Programma.
BIBLIOGRAFIA
Caballero, «The Global Epidemic of Obesity».;
«WHO | Obesity and overweight».
Istituto Auxologico Italiano, «7° Rapporto sull’obesità in Italia ‑ Obesità e genetica: oltre lo stile di vita».
Institute of Medicine of the National Academies: Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids (macronutrients). Wash- ington, DC , National Academies Press; 2002.
Joint Position Statement: nutrition and athletic performance. American College of Sports Medicine, American Dietetic Association, and Dietitians of Canada. Med Sci Sports Exerc 2000, 32(12):2130-2145.
Tarnopolsky M: Protein requirements for endurance athletes. Nutrition 2004, 20(7-8):662-668.
Commentary. International Society of Sports Nutrition position stand: protein and exercise. B Campbell, R B Kreider, T Ziegenfuss, P La Bounty, M Roberts, D Burke, J Landis, H Lopez and J Antonio. Journal of the International Society of Sports Nutrition 2007, 4:8.
Knight EL, Stampfer MJ, Hankinson SE, Spiegelman D, Curhan GC: The impact of protein intake on renal function decline in women with normal renal function or mild renal insuffi- ciency. Ann Intern Med 2003, 138(6):460-467.
Lemon PW: Beyond the zone: protein needs of active individ-uals. J Am Coll Nutr 2000, 19(5 Suppl):513S-521S.
A H. Manninen. High-protein weight loss diets and purported adverse effects: where is the evidence? Sports Nutrition Review Journal. 1(1):45-51, 2004.
Metges CC, Barth CA: Metabolic consequences of a high dietary-protein intake in adulthood: assessment of the available evidence. J Nutr 2000, 130(4):886-889.
Brenner BM, Meyer TW, Hostetter TH: Dietary protein intake and the progressive nature of kidney disease: the role of hemodynamically mediated glomerular injury in the patho- genesis of progressive glomerular sclerosis in aging, renal ablation, and intrinsic renal disease. N Engl J Med 1982, 307(11):652-659.
Calderon JL, Zadshir A, Norris K: A survey of kidney disease and risk-factor information on the World Wide Web. Med Gen Med 2004, 6(4):3.
Lindheimer MD, Katz AI: Physiology and Pathophysiology. In Renal physiology and disease in pregnancy 2nd edition. Edited by: Seldin DW, Giebisch G. New York , Raven Press ; 1992:3371–3431.
Food and Nutrition Board, Institute of Medicine: Macronutrient and Healthful Diets. In Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients) Washington, D.C. , The National Academies Press; 2002:609-696.
St. Jeor ST, Howard BV, Prewitt E et al. Dietary protein and weight reduction: A statement for health care professionals from the Nutrition Committee of the Council on Nutrition, Physical Activity, and Metabolism of the American Heart Association. Circulation 2001;104:1869-1874.
Street C. High-protein intake – Is it safe? In: Antonio J, Stout JR, eds. Sports Supplements. Philadelphia: Lippincott Williams & Wilkins, 2001, pp. 311-312.
Walser M. Effects of protein intake on renal function and on the development of renal disease. In: The Role of Protein and Amino Acids in Sustaining and Enhancing Performance. Committee on Military Nutrition Research, Institute of Medicine. Washington, DC: National Academies Press, 1999, pp. 137-154.
Poortmans JR, Dellalieux O. Do regular high-protein diets have potential health risks on kidney function in athletes? Int J Sports Nutr 2000;10:28-38.
Lentine K, Wrone EM. New insights into protein intake and progression of renal disease. Curr Opin Nephrol Hypertens 2004;13:333-336.
Campbell A. Tackling “diabesity” head-on. Joslin Diabetes Center’s new nutrition guideline. Diabetes Self Manag 2005;22:40, 42–4.
H Frank, J Graf, U Amann-Gassner, R Bratke, H Daniel, U Heemann, and H Hauner. Effect of short-term high-protein compared with normal-protein diets on renal hemodynamics and associated variables in healthy young men Am J Clin Nutr 2009;90:1509–16.
Lew SW, Bosch JP. Effect of diet on creatinine clearance and excretion in young and elderly healthy subjects and in patients with renal disease. J Am Soc Nephrol 1991;2:856–65.
Brandle E, Sieberth HG, Hautmann RE. Effect of chronic dietary protein intake on the renal function in healthy subjects. Eur J Clin Nutr 1996;50: 734–40.
Wiegmann TB, Zlomke AM, MacDougall ML, Kipp DE. Controlled changes in chronic dietary protein intake do not change glomerular filtration rate. Am J Kidney Dis 1990;15:147–54.
Bosch JP, Lew S, Glabman S, Lauer A. Renal hemodynamic changes in humans: response to protein loading in normal and diseased kidneys. Am J Med 1986;81:809–15.
Solerte SB, Rondanelli M, Giacchero R, et al. Serum glucagon concentration and hyperinsulinaemia influence renal haemodynamics and urinary protein loss in normotensive patients with central obesity. Int J Obes Relat Metab Disord 1999;23:997–1003.
Barba G, Cappuccio FP, Russo L, Stinga F, Iacone R, Strazzullo P. Renal function and blood pressure response to dietary salt restriction in normotensive men. Hypertension 1996;27:1160–4.
Ikizler TA. Nutrition support and management of renal disorders. In: Bronner, F. ed. Nutritional Aspects and Clinical Management of Chronic Disorders and Diseases. Boca Raton, FL: CRC Press, 2003, pp. 156-175.
Klahr S, Levey AS, Beck GJ et al. The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal failure. N Engl J Med 1994;330:877-884.
American Diabetic Association. Evidence-based nutrition principles and recommendations for the treatment and prevention of diabetes and related complications. Diabetes Care 2002;25:S50-S60.
Gannon MC, Nuttall FQ, Saeed A et al. An increase in dietary protein improves the blood glucose response in persons with type 2 diabetes. Am J Clin Nutr 2003;78:734-41
Cooper C, Atkinson EJ, Hensrud DD et al. Dietary protein intake and bone mass in women. Calcif Tissue Int 1996;58:320-325.
Geinoz G, Rapin CH, Rizzoli R et al. Relationship between bone mineral density and dietary intakes in the elderly. Osteoporos Int 1993;3:242-8. 38. Michaelsson K, Holmberg L, Mallmin H. Diet, bone mass, and osteocalcin: a cross-sectional study. Calcif Tissue Int)1995;57:86-93.
Kerstetter JE, O ́Brien KO, Insogna KL. Dietary protein affects intestinal calcium absorption. Am J Clin Nutr 1998;68:859-865.
Kerstetter JE, Svastislee C, Caseria D et al. A threshold for low-protein-diet-induced elevations in parathyroid hormone. Am J Clin Nutr 2000;72:168-173.
Giannini S, Nobile M, Sartori L et al. Acute effects of moderate dietary protein restriction in patients with idiopathic hypercalciuria and calcium nephrolithiasis. Am J Clin Nutr 1999;69:267-271.
Schurch MA, Rizzoli R, Slosman D et al. Protein supplements increase serum insulin-like growth factor-I levels and attenuate proximal femur bone loss in patients with recent hip fracture: A randomized, double-blind, placebo-controlled trial. Annals Internal Med 1998;128:801-809.
Avenell A, Handoll H. Nutritional supplementation for hip fracture aftercare in the elderly. Cochrane Database Syst Rev 2004;1:CD001880.
Ginty F. Dietary protein and bone health. Proc Nutr Soc 2003;62:867-76.
Dawson-Hughes B, Harris SS, Rasmussen H et al. Effect of dietary protein supplements on calcium excretion in healthy older men and women. J Clin Endocrinol Metab 2004;89:1169-73
Obarzaneck E, Velletri PA, Cutler JA. Dietary protein and blood pressure. JAMA 1996;275:1598-1603.
Reed D, McGee D, Yano K, Hankin J. Diet, blood pressure, and multicollinearity. Hypertension 1985;7:405-410
Zhou B, Wu X, Tao SQ. Dietary patterns in 10 groups and the relationship with blood pressure. Collaborative Study Group for Cardiovascular Diseases and their Risk Factors. Chin Med J 1989;102:257-261
Stamler JS, Caggiuala A, Grandist GA. Relationship of dietary variables to blood pressure (BP) findings of the Multiple Risk Factors Intervention Study (MRFIT). Circulation 1992;85:867, Abstract 23.
Kuchel O. Differential catecholamine responses to protein intake in healthy and hypertensive subjects. Am J Physiol 1998;R1164-R1173.
Hu FB, Stampfer MJ, Manson JA et al. Dietary protein and risk of ischemic heart disease in women. Am J Clin Nutr 1999;70:221-227.
Navder KP, Lieber CS. Nutritional support in chronic disease of the gastrointestinal tract and the liver. In: Bronner, F. ed. Nutritional Aspects and Clinical Management of Chronic Disorders and Diseases. Boca Raton, FL: CRC Press, 2003, pp. 45-68.
Volek JS, Sharman MJ, Love DM et al. Body composition and hormonal responses to a carbohydrate-restricted diet.Metabolism 2002;51:864-870
Srivastava N, Singh N, Joshi YK. Nutrition in management of hepatic encephalopathy. Trop Gastoenterol 2003;24:59-62
Feinman RD, Fine EJ. Thermodynamics and metabolic advantage of weight loss diets. Metab Synd Relat Disord 2003;1:209-219.